Les vaccins contre la Covid sont-ils encore en phase de test? C’est la question qui agite la complosphère ces derniers temps.
Il existe plusieurs modes de diffusion des infoxs. Elles sont soient « officielles », lancées par un « leader » dans son domaine (de la désinformation bien souvent comme tous les lanceurs d’alertes bidons auto proclamés), ceux qui sont lancés par un « militant » peu connu ou par des moyens d’astroturfing, et ceux qui se développent en « infra communication » (terme inventé par nos soins). Ceux là viennent du fond de discussion des complotistes et émergent plus ou moins spontanément.
L’infox dont nous parlons aujourd’hui fait partie de ceux là. Il a bien infusé le discours complotiste et ressort systématiquement comme « argument » chez les antivax. Les vaccins contre le covid seraient toujours en phase de test, d’où les commentaires trouvés en nombre sur ce sujet, comme par exemple sur un article du Monde parlant de l’internement de « Fourtillan« :
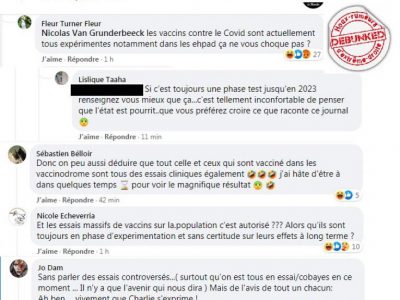
Corollaire: les personnes vaccinées au Pfizer Moderna ou à l’Astra Zeneca sont des « cobayes » de « big pharma »… Et quoi que vous leur répondiez, ils ressortent le dogme antivax indéfiniment. Bien entendu, PAS UN n’a jamais ouvert un site ou un bouquin expliquant le protocole de mise sur le marché des médicaments. Alimentant ainsi leur « Dunning-Kruger« …

MàJ du 18/04/2021 à 18h30
Un de nos lecteurs, Clément S. a eu la gentillesse de nous faire connaitre l’existence de ce tract déposé sur les voitures du parking du CHU de Rouen. Comme on vous le disait c’est un infox qui circule bien en ce moment:

Reprenons à zéro.
Comme l’indique ce site officiel, les études puis la mise sur le marché d’un médicament (vaccins y compris) obéis à un protocole d’étude divisé en 5 parties:une phase « préclinique », puis 3 phases d’études, puis post mise sur le marché qui correspond à la quatrième phase.
DÉROULEMENT DE LA RECHERCHE SUR LES VACCINS
Avant de commencer les études chez l’homme, il est nécessaire de passer par une phase de test appelée phase de développement « préclinique ». Cette phase a lieu au laboratoire, puis chez l’animal. Elle permet :
- de déterminer les doses optimales qui permettent de protéger sans entraîner de toxicité (innocuité) ;
- de vérifier que ce vaccin est sans danger aux doses utilisées (tolérance) ;
- de vérifier qu’il est efficace pour stimuler nos défenses immunitaires (pouvoir immunogène).
Les recherches sont faites chez différentes espèces animales en utilisant la même voie d’administration que celle qui sera utilisée chez l’homme.
Lorsque cette phase préclinique s’est déroulée avec succès, et comme pour tout médicament, le développement d’un vaccin nécessite que des « essais cliniques » soient réalisés chez l’homme. Ces essais cliniques se déroulent en quatre phases. Ils ont pour objectif de déterminer la tolérance et l’efficacité du vaccin chez l’homme.
Pour pouvoir débuter, l’essai clinique doit avoir obtenu un avis favorable du Comité de protection des personnes (CPP) et une autorisation de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
- Phase 1 : sur 10 à 100 personnes : première administration chez l’homme (qui se fait toujours chez l’adulte en bonne santé même si le vaccin concerne l’enfant). On étudie la tolérance et la production des anticorps (pouvoir immunogène) en fonction des doses que l’on administre.
- Phase 2 : sur 50 à 500 personnes : on étudie la tolérance avec la formulation finale du vaccin et le nombre de doses retenues (schéma de vaccination) dans la population à laquelle cette vaccination sera recommandée.
- Phase 3 : on étudie l’efficacité vaccinale et la tolérance à une grande échelle, chez plusieurs milliers de personnes.
- Phase 4 : ces études sont réalisées après la mise sur le marché du vaccin. Elles permettent de vérifier qu’à grande échelle et chez des personnes pouvant présenter des affections chroniques, l’innocuité et l’efficacité du vaccin sont assurées, qu’il n’y a pas d’effets indésirables à long terme sur la survenue d’autres maladies.
Les études et les tests des phases 1 et 2 évaluent notamment les caractéristiques de la protection provoquée par le vaccin en fonction de différentes doses, l’interaction avec d’autres vaccins et le schéma de vaccination.
Le pouvoir immunogène et la tolérance sont évalués au cours des phases 1 à 3, et la qualité de la protection essentiellement au cours de la phase 3 puis de la phase 4.
C’est en fonction des résultats des essais de phase III, le laboratoire promoteur pourra faire une demande d’autorisation de mise sur le marché (AMM) qui permettra plus tard la commercialisation du nouveau produit.
Après leur commercialisation, les médicaments continuent à faire l’objet d’un suivi strict à long terme, dit post-AMM ou « phase IV », afin d’identifier tout effet secondaire grave et/ou inattendu dû à son administration. On parle de pharmacovigilance. Les essais de phase IV peuvent aussi être destinés à évaluer ce nouveau médicament approuvé dans des conditions d’administration différentes, par exemple la fréquence d’administration, le nombre de cures, la durée de la perfusion…
On comprend donc très bien que même si l’évaluation « post AMM » porte aussi le nom de phase 4, ce n’est plus une « phase d’essai ». Les phases d’essais réels, ce sont les 3 premières phases. En fait un médicament ne sort JAMAIS de la phase 4 puisqu’il reste ad vitam aeternam sous surveillance. C’est ainsi que des décennies après, pour X raisons, les autorités peuvent se décider à retirer un médicament sur le marché, soit parce que de nouveaux plus efficaces sont arrivés en vente, ou bien parce que des études longues ont montré un rapport bénéfice/risque au final moins intéressant qu’attendu.
Les effets secondaires de l’astra zeneca, abondamment commenté ces dernières semaines sont repérés justement parce que ce vaccin est en surveillance « post AMM ». Effets secondaires largement repris comme « preuve » de la nocivité des vaccins selon les complotistes antivax. La balance bénéfice/risque reste pourtant largement bénéficiaire en faveur du vaccin. Futura Sciences a pu estimer que le risque de développer une thrombose après avoir développé la covid était de dix à 20 fois supérieures à celui engendré par la vaccination avec l’astra zeneca. Mais que voulez vous, les complotistes sont déjà fâchés avec les maths en général, vous n’allez pas leur demander de faire mieux avec les statistiques en particulier!
Lorsque un médicament est récent, l’AMM peut être conditionnelle.
Une autorisation de mise sur le marché (AMM) conditionnelle permet l’autorisation de médicaments qui répondent à un besoin médical non satisfait avant que des données à long terme sur l’efficacité et la sécurité ne soient disponibles. Cela est possible uniquement si les données d’efficacité et de sécurité disponibles sont positives et que les bénéfices de la disponibilité immédiate du médicament l’emportent sur le risque inhérent à l’absence de recul important. Une AMM conditionnelle peut être envisagée dans des situations d’urgence en réponse à des menaces pour la santé publique à l’image de la Covid-19. Une fois qu’une AMM conditionnelle a été accordée, les laboratoires doivent fournir les données complémentaires provenant d’études nouvelles ou en cours, dans des délais fixés par l’EMA pour confirmer le rapport bénéfices / risques positif. Une AMM conditionnelle est accordée pour un an et peut être renouvelée. Lorsque les autorités européennes ont reçu et évalué toutes les données complémentaires exigées, l’AMM conditionnelle peut être convertie en une AMM standard.
C’est le cas de tous les vaccins contre la Covid mis sur le marché actuellement. Ces vaccins sont donc mis sous « surveillance renforcée« . Mais ils ne sont pas seuls! Tous les nouveaux médicaments sont ainsi mis sous surveillance… Et aussi ceux dont l’étude à long terme a indiqué des signes potentiels de dangerosité (balance défavorable bénéfice/risque). Ils sont au nombre de 77.
Et d’autres médicaments plus anciens peuvent, eux aussi être mis sous surveillance renforcée.
Est ce pour cela que les patients consommateurs de ces médicaments sont des « cobayes »? Certes non, à moins de considérer que tous les consommateurs de médicaments, réguliers ou occasionnels sont des cobayes, puisque tous toujours en phase 4!
Debunked !!!